Danke Matthias,
ich hatte ich immer gefragt wie eigentlich Tritium in der Leuchtmasse eingebunden ist. Wenn wir radioaktives in vitro labeing machen benutzen wir immer triitierte lipide oder polymere. Ich wuerde gerne mal rausfinden, welche Verbindung genau in der Leuchtmasse benutzt wird, denn gasfoermig ist das Tritium auf gar keinen Fall integriert. Da wuerde es viel zu schnell rausdiffundieren, auch einer der Hauptprobleme bei der Wasserstoffspeicherung...
Gerhard,
Ich glaube, Du meinst Zinksulfid anstatt Zinksulfit, oder :-).
Viele Gruesse
Markus
Ergebnis 21 bis 40 von 68
Thema: Tritium Leuchtdauer
-
29.06.2009, 13:07 #21Submariner

- Registriert seit
- 24.01.2006
- Beiträge
- 300
Hallo an Alle,
bei meinen beiden Beiträgen ist mir leider
ein grober, unverzeilicher Fehler unterlaufen:
Statt
"Zinkoxyd"
mus es heißen:
"Zinksilikat".
Also bitte gedanklich "Zinkoxyd" durch "Zinksilikat"
Meine Aussagen bleiben aber richtig!
Ich bitte vielmals um Entschuldigung.
Bitte auch hier nachschauen: Leuchtfarben
Dort steht auch etwas über die Verfärbung von Leuchtfarben!
Eine weitere Quelle: Leuchtstoff
Gruß
Gerhard
-
29.06.2009, 13:24 #22Datejust

- Registriert seit
- 31.12.2005
- Beiträge
- 106
-
29.06.2009, 13:52 #23Submariner

- Registriert seit
- 24.01.2006
- Beiträge
- 300
Hallo Markus, Gerhard,
Gerhard,
Ich glaube, Du meinst Zinksulfid anstatt Zinksulfit, oder :-).
vielen Dank für den Hinweis.
Ich bin völlig durcheinander!
IWC spricht von "Sulfit", die meisteren anderen sprechen von "Sulfid". IWC
In meinen beiden ersten Posts habe ich statt von "Silikat" fälschlicherweise von "Oxyd", oder heißt es "Oxid"?, gesprochen.
Da rächt es sich, dass ich in der Schule im Fach Chemie nicht
richtig aufgepasst habe!
habe!
Deshalb fasse ich so zusammen:
Es gibt eine Zinkverbindung, die wird durch Licht und durch Tritium angeregt und es gibt eine Zinkverbindung, die wird durch Tritium aber
nicht durch Licht angeregt. Uff, das war eine schwere Geburt!
Gruß
Gerhard
-
29.06.2009, 13:55 #24
Tech-Talk at its best.

Ich kann nur staunen. Vielen, vielen Dank.
Bezüglich der Verfärbungen hatte Stephen (steboe) eine Theorie, die er aber erst wissenschaftlich belegen kann wenn Tritium-Blätter noch ein wenig stärker im Preis fallen. Ich krieg das leider nicht mehr zusammen.
Ich krieg das leider nicht mehr zusammen.
Beste Grüße,
Charly
WWWWDWWWWWWWWWWWWWWDWDWWWWWDWWWWWWDWWWWWWWWDD
-
29.06.2009, 14:05 #25
Ah, Ein Chemie Vortrag! Sehr interessant.
Grossen Dank an die Erklärenden!!! Gruss Pascal
Gruss Pascal
-
29.06.2009, 14:24 #26Submariner

- Registriert seit
- 24.01.2006
- Beiträge
- 300
Welcher Chemiker kann mir helfen?
Ich habe soeben folgenden Link gefunden:
Zinksilikat
Also ist Zinksilikat ein Gemisch von Wasserglas und Zinkoxyd (oder: Oxid?).
Dann wäre Zinkoxyd doch nicht so falsch, oder?
Wer kann noch folgen?
Gruß
Gerhard
-
29.06.2009, 15:01 #27Datejust

- Registriert seit
- 31.12.2005
- Beiträge
- 106
Hi Gerhard,
sorry, wollte nicht den Pedanten raushaengen lassen nur der Richtigkeit alber, Zinksulfid ist ZnS, Zinksulfit ist ZnSO3 und zink sulfat ist Zn3(SO4)2. Dies ist wichtig fuer die weitere Diskussion.
Bezueglich Deiner Frage: Zinkoxid ist voellig richtig, Silikate bilden polymere und in diese koennen dann unterschiedliche Fremdverbindungen eingebettet sein, wie z.B Zinkoxid. Wasserglass z.B hat die Konsistenz von Gelee.
Die offenen Fragen aber bleiben:
1) In welcher Verbindung wurde Tritium in die Leuchtmasse eingebettet (organische oder anorganische)
2) Welches Bindemittel oder Grundsubstanz wurde fuer die Farbe verwendet
ZnS ist nicht besonders stabil sondern kann zu Zinksulfat oxidieren. Zinkoxid ist super stabil, wird deshalb auch als weisszusatz in Farben verwendet (neben Titanoxid). Waere bestimmt interessant zu schauen, ob das Zinksulfid fuer die Gelbfaerbung verantwortlich ist. Die Oxidation wird auch durch die Umwelteinfluesse beeinflusst, Wie Matthias dargelegt hat)
Denn wenn, wie Du sagst, es zwei verschiedene Leuchtfarben gibt, einmal mit Zinkoxid und zum anderen mit Zinksulfid, so sollte (wenn denn die sulfid oxidation verantwortlich ist) nur die Sulfidblaetter gelb werden und nicht die Oxidblaetter.
Also, alle, die gelbe Blaetter haben, mal mit der Taschenlampe bestrahlen wie Gerhard schreibt.
Viele Gruesse
Markus
-
29.06.2009, 15:42 #28Submariner

- Registriert seit
- 24.01.2006
- Beiträge
- 300
Hallo Markus,
von "Pedanten raushaengen lassen" kann ja überhaupt keine Rede sein.
Das Thema interessiert mich schon länger und Deine Ausführungen
sind hochinteressant. Vielleicht kann man die Aussagen tatsächlich
durch Anleuchten verifizieren?
Hier ein Beispiel aus meiner Sammlung:

Beide Blätter sind aus 1966/67, das linke ist eines der ersten
matten Blätter mit fast noch weißen Indexen, das rechte ist
eines der letzten Glanzblätter mit stärker gelblich verfärbten
Indexen.
Ergebnis des Taschenlampentests:
Linkes Blatt: leuchtet nicht.
Rechtes Blatt: Leuchtet stark auf.
Nach längerer Zeit haben beide Blätter ein schwaches Leuchten, das
nur in totaler Dunkelheit zu erkennen ist.
Es wäre doch interessant zu erfahren, wann Rolex Zinksulfid und
wann Zinkoxid verwendet hat. Vielleicht könnte dies zur besseren Erkennung von Fälschungen führen?
Gruß
Gerhard
P.S.: Übrigens, die Zeiger der linken 1675 sind mit Superluminova belegt!
-
29.06.2009, 15:47 #29Steve McQueen

- Registriert seit
- 18.02.2004
- Ort
- Ditschiland
- Beiträge
- 27.174
die hier schon x mal gestellt wurde und auch schon x mal beantwortet wurde ...Original von PCS
Danke Matthias für die hervorragende Erklärung.
Danke auch Gerhard, vor allem dafür:
Das klärt eine alte Frage von mir.Original von Der Stuttgarter
5. Ihr könnt erkennen, ob eine ältere Uhr mit Zinksulfit oder Zinkoxyd
belegt ist. Zinksulfit leuchtet bei Bestrahlung mit Licht hell auf,
Zinkoxyd nicht! Beide leuchten aber durch die Bestrahlung
mit Tritiumpolymer!


leider wurden meine erklärungen dazu ja nicht für wahr genommen
mal zinksulfid in die suche eingeben VG
VG
Udo
-
29.06.2009, 15:47 #30ehemaliges mitgliedGastWenn man jetzt mal kollaterale physikalische Alterungsphaenomene wie die o.g. ausser Acht laesst, ergibt sich aus diesem Diagramm, dass theoretisch (rein nach dem Zerfallsgesetz) fast alle Tritiumblatter noch schwach leuchten koennen.Original von Prof. Rolex
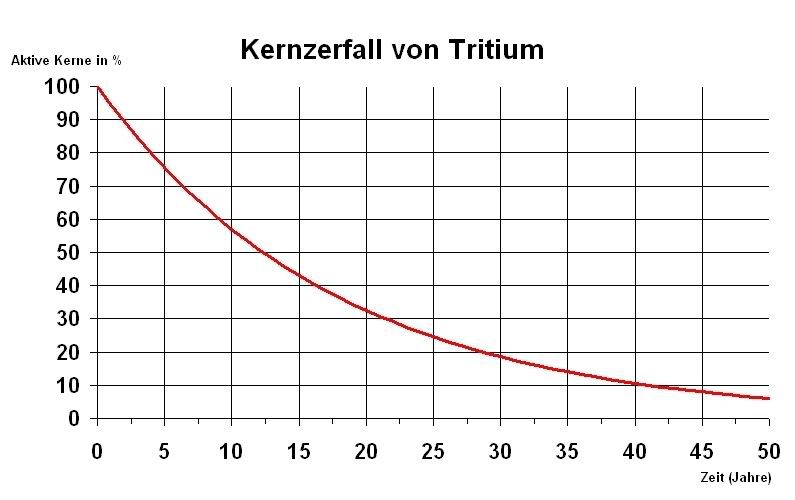
Die Dunkeladaptation des menschl. Auges kann uebrigens bis zu 15-30 Minuten dauern. D.h. man muss ev. so lange im Dunkeln sitzten bis man Restleuchten ueberhaupt wahrnehmen kann.
Kennt man so aehnlich vom Sterne kucken, je laenger man schaut, um so mehr Sterne entdeckt man.
Schade, dass man nicht praezise genug zurueckrechnen kann.
Z.B. so:
Bei meiner 6538 leuchtet das Tritium noch ganz leicht.
Vielleicht 20% - ein Blick in Matthias' Diagramm sagt mir dann:
max. Blattalter 30 Jahre.
Theoretisch
-
29.06.2009, 16:01 #31Datejust

- Registriert seit
- 31.12.2005
- Beiträge
- 106
Hi Gerhard,
Super interessant, wir braeuchten noch ein paar mehr Beispiele. Ich werde mal bei meiner 5513 mit srak gelben indizes schauen. Vielleicht koennen die Cracks mit ihrem "Altmetall" da mal beisteuern?
Die Ziffernblaetter sind ja sowieso von Zulieferfirmen und ob die so genau gewusst haben welche Farbe die in welchem Batch verwendet haben?
Weiss jemand, wer der Produzent/die Poduzenten der Farbe waren? Diese radioaktiven Verbindungen werden auf der gesamten Welt nur von einer Handvoll Firmen produziert wie z. B NEN (New England Nuclear, jetzt Perkin Elmer). Ob die auch die Farbe hergestellt haben und damit einige Zinksulfid und andere Zinkoxid verwendet haben?
Fragen ueber Fragen
Viele Gruesse
Markus
-
29.06.2009, 16:15 #32Submariner

- Registriert seit
- 24.01.2006
- Beiträge
- 300
Hallo Hugo,
entschuldige, dass ich Dich nicht richtig gewürdigt habe.
Nein, Spass beiseite! Selbstverständlich wurde das Problem
hier schon x-mal behandelt. Auch von Deiner Seite gab es
schon x Beiträge.
Es schien mir aber trotz aller Beiträge wichtig, auf die
Unterschiede des Materials und seine Eigenschaft bei der
Bestrahlung mit Licht hinzuweisen: Zinksulfid leuchtet,
Zinksilikat (bzw. Zinkoxid) leuchtet bei Bestrahlung nicht!
Ich kenne viele Sammler, die durch diese unerschiedlichen
Eigenschaften verwirrt wurden, mich eingenommen.
Wie oft wurde der Kauf einer Vintage mit der Begründung
"Die Indexe leuchten ja, also ist das SL oder relumed" abgelehnt?
In Wirklichkeit war es Zinksulfid!
Jetzt kann man die Eigenschaft der Leuchtmassen, die Rolex
in 90-er Jahren verwendet hat erklären, oder? Wenn Sie grünlich
aufglühen und dann verlöschen ist es Zinksulfid, oder?
Wann ist es Zinksulfid oder Superluminova? Beide leuchten bei
Beleuchtung auf, oder?
Gruß
Gerhard
-
29.06.2009, 16:22 #33Datejust

- Registriert seit
- 31.12.2005
- Beiträge
- 106
Der Unterschied Luminova und Zinksulfid ist schon dieskutiert worden und sorry an alle wenn nicht genuegend gewuerdigt.
Ob Zinkoxid blaetter altern bzw gelb werden und oder nur Zinksulfid ist bisher noch nicht diskutiert worden. Ich finde das spannend, lass mal weitere Anhaltspunkte sammeln. Haben andere Leute vielleicht ein paar Daten zu "Taschenlampentest" und Farbe des Ziffernblattes?
Markus
-
29.06.2009, 16:24 #34ehemaliges mitgliedGast
Termi hat glaubich mal eine groessere Experimentalserie durchgefuehrt

-
29.06.2009, 16:25 #35Steve McQueen

- Registriert seit
- 18.02.2004
- Ort
- Ditschiland
- Beiträge
- 27.174
Wann ist es Zinksulfid oder Superluminova? Beide leuchten bei
Beleuchtung auf, oder?
ja
wobei zinksulfid sich binnen kürzester zeit(max 60 sec.) "runterdimmt" und sl weiter fröhlich vor sich her leuchtet.VG
Udo
-
29.06.2009, 16:42 #36Submariner

- Registriert seit
- 24.01.2006
- Beiträge
- 300
Zitat Hugo:
Hallo Hugo,wobei zinksulfid sich binnen kürzester zeit(max 60 sec.) "runterdimmt" und sl weiter fröhlich vor sich her leuchtet.
das ist so nicht ganz richtig.
Nach meinen eigenen Erfahrungen dauert es mindestens 30-45 Minuten,
bis Zinksulfid nicht mehr nachleuchtet, sondern vom Tritium angeregt wird.
Schau mal bei IWC nach:
IWC
Gruß
Gerhard
-
29.06.2009, 16:50 #37Steve McQueen

- Registriert seit
- 18.02.2004
- Ort
- Ditschiland
- Beiträge
- 27.174
iwcOriginal von Der Stuttgarter
Zitat Hugo:
Hallo Hugo,wobei zinksulfid sich binnen kürzester zeit(max 60 sec.) "runterdimmt" und sl weiter fröhlich vor sich her leuchtet.
das ist so nicht ganz richtig.
Nach meinen eigenen Erfahrungen dauert es mindestens 30-45 Minuten,
bis Zinksulfid nicht mehr nachleuchtet, sondern vom Tritium angeregt wird.
Schau mal bei IWC nach:
IWC
Gruß
Gerhard
falsches forum
nein spass
bei rolex kenne ich es nur so wie beschrieben,kurzes helles aufleuchten,dann sehr schnell (können eventuell auch ein paar sek. mehr sein) abdimment und dann konstant schwach weiterleuchtend.VG
Udo
-
29.06.2009, 17:15 #38Submariner

- Registriert seit
- 24.01.2006
- Beiträge
- 300
Hallo Hugo,
Du hast mich falsch verstanden.
Bei meinen Rolex-Uhren dauert es
30-45 Minuten, bis das Nach-Leuchten
bei Zinksulfid-Blättern aufhört.
Den Beitrag von IWC habe ich nur als zusätzliches
Argument gebracht.
Ich sammle und besitze nur Rolex-Uhren!
Gruß
Gerhard
-
29.06.2009, 17:39 #39Original von Der Stuttgarter
Hallo Markus,
von "Pedanten raushaengen lassen" kann ja überhaupt keine Rede sein.
Das Thema interessiert mich schon länger und Deine Ausführungen
sind hochinteressant. Vielleicht kann man die Aussagen tatsächlich
durch Anleuchten verifizieren?
Hier ein Beispiel aus meiner Sammlung:

Beide Blätter sind aus 1966/67, das linke ist eines der ersten
matten Blätter mit fast noch weißen Indexen, das rechte ist
eines der letzten Glanzblätter mit stärker gelblich verfärbten
Indexen.
Ergebnis des Taschenlampentests:
Linkes Blatt: leuchtet nicht.
Rechtes Blatt: Leuchtet stark auf.
Nach längerer Zeit haben beide Blätter ein schwaches Leuchten, das
nur in totaler Dunkelheit zu erkennen ist.
Es wäre doch interessant zu erfahren, wann Rolex Zinksulfid und
wann Zinkoxid verwendet hat. Vielleicht könnte dies zur besseren Erkennung von Fälschungen führen?
Gruß
Gerhard
P.S.: Übrigens, die Zeiger der linken 1675 sind mit Superluminova belegt!
Und hier ein Beispiel aus meiner "Sammlung":

Links: 208xxxx Seriennummer (ca. 1968). Taschenlampe: leuchtet nicht auf.
Rechts: 508xxxx Seriennummer (ca. 1977). Taschenlampe: leuchtet schwach auf.
Nach längerer Dunkelheit leuchten beide konstant weiter, die Linke sehr
schwach, die Rechte etwas stärker.Gruß Percy

"Ferner wird hier auch auf Ihrem Profil sehr viel Diversität benötigt."
-
29.06.2009, 18:14 #40Datejust

- Registriert seit
- 31.12.2005
- Beiträge
- 106
Hi Percy,
hab vielen Dank. Scheint ja aehnlich wie bei Gerhard zu sein?
Hat jemand zugriff zu diesem Artikel?
http://www3.interscience.wiley.com/j...33246/abstract
Da scheint die Zusammensetzung der Tritiumfarbe genauer beschrieben zu sein. Ich schau mal ob ich rankomme. Bisher habe ich nur gefunden, das das Tritium in organischer Form in der Farbe vorhanden ist. Aber welche genau??
Ähnliche Themen
-
Tritium
Von riesling1965 im Forum Rolex - Tech-TalkAntworten: 15Letzter Beitrag: 29.07.2006, 10:10 -
Tritium ade?
Von herthinho im Forum Rolex - Haupt-ForumAntworten: 29Letzter Beitrag: 02.02.2005, 16:17 -
DJ Tritium-ZB
Von Rocco im Forum Rolex - Haupt-ForumAntworten: 9Letzter Beitrag: 26.01.2005, 21:15



 Zitieren
Zitieren




Lesezeichen